新产品开发流程(产品研发项目管理流程)
- 热门分享
- 2024-05-15
- 139
新产品开发流程
完成所有三个阶段的临床试验并分析所有资料及数据,*的安全性和有效性得到了证明,新药持有人则可以向药监部门提交新药申请。新药申请需要提供所有收集到的科学资料。通常一份新药申请材料可多达100000页,甚至更多!按照法规,FDA应在6个月内审评完新药申请。但是由于大部分申请材料过多,而且有许多不规范,因此往往不能在这么短的时间内完成。中国药监局也在努力改进工作,期望缩短审批时间。
现代生物医学的研究进展,以及人类基因图谱的建立,让人类对疾病的机理了解更加准确,为新药开发提供了明确的方向、具体的靶标。
*研发→临床前研究→临床试验(I期、II期、III期)→新药申请、批准上市和上市后监测(IV期临床试验)。
研发一款新药,首先要确定通过这款药来*什么疾病,这类疾病的发病原理是怎么样的,然后根据疾病的发病原理去确定*作用的靶点。
证明该化合物针对特定目标疾病具有生物活性,同时评估*对疗效以外的作用,比如可能的副作用,尤其是对心血管、呼吸、中枢*系统的影响。
产品研发项目管理流程
了解*在动物体内的吸收、分布、*、排泄(ADME),这些数据可以指导临床研究以何种形式给药(口服、吸入、针剂),给药频率与剂量。
结语:新药研发是一个高风险,高投入,当然也是高回报的行业。研发周期长,涉及多学科、多专业的密切配合与协调。随着科技的发展,我们利用新兴手段AI去提升新药研发到上市的效率。我国AI*研发主要应用在*发现阶段,其中,靶点发现、先导化合物研究和化合物筛选、化合物合成是“AI+*发现”最热门的领域,按照应用场景的发展速度来看,未来*发现、合成或将成自动化程度最高的方向。
当一个化合物通过了临床前试验后,需要向药监部门(C)FDA提交新药临床研究申请(IND),以便可以将该化合物应用于人体试验。
围绕先导化合物,设计并合成大量新化合物,通过对所合成化合物活性数据与化合物结构的构效关系分析,进一步有效的指导后续的化合物结构优化和修饰,以期得到活性更好的化合物。
通过构效关系研究,几轮优化所有筛选出来的满足基本生物活性的最优化合物,一般就选作为候选*,进入开发。候选*的确定标志着分子设计、化学合成、生物评价循环反馈的完成,达到了新药开发的标准。
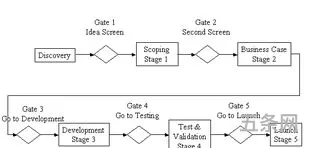
研发项目流程八个阶段
*在大范围人群应用后,需要对其疗效和不良反应继续进行监测。药监部门要求根据这一阶段的监测结果来修订*使用说明书。这一阶段研究还会涉及到的一些内容有,*配伍使用的研究,*使用*。如果批准上市的*在这一阶段被发现之前研究中没有发现的严重不良反应,比如显著增加服药人群心血管疾病发生率之类的,*还会被监管部门强制要求加注警告说明,甚至下架。
将试验新药给一定数量的病人志愿者,评价*的药代动力学和排泄情况。这是因为*在患病状态的人体内的作用方式与健康志愿者是不同的,对那些影响肠、胃、肝、和*的*尤其如此。
开发一种新药从计划开始到药品上市是一个漫长的过程,花费的时间可能需要一二十年之久,在经历上数百万道工序过后,才有可能会研发。



















有话要说...